Bảng tuần hoàn (tên đầy đủ là Bảng tuần hoàn các nguyên tố hóa học, còn được biết với tên Bảng tuần hoàn Men-đê-lê-ép) là một phương pháp liệt kê các nguyên tố hóa học thành dạng bảng, dựa trên số hiệu nguyên tử (số proton trong hạt nhân), cấu hình electron và các tính chất hóa học tuần hoàn của chúng
1. Nguyên tố hóa học là gì?
Nguyên tố hóa học, thường được gọi đơn giản là nguyên tố, là một chất hóa học tinh khiết, bao gồm một kiểu nguyên tử, được phân biệt bởi số hiệu nguyên tử, là số lượng proton có trong mỗi hạt nhân. Không giống như các hợp chất hóa học, các nguyên tố hóa học không thể bị phân hủy thành các chất đơn giản hơn bằng các phương pháp hóa học. Số proton trong hạt nhân là đặc tính xác định của một nguyên tố và được gọi là số nguyên tử của nó (được biểu thị bằng ký hiệu Z) – tất cả các nguyên tử có cùng số hiệu nguyên tử đều là nguyên tử của cùng một nguyên tố.
Tất cả các baryon vật chất của vũ trụ bao gồm các nguyên tố hóa học. Khi các nguyên tố khác nhau trải qua các phản ứng hóa học, các nguyên tử được sắp xếp lại thành các hợp chất mới được kết nối với nhau bằng các liên kết hóa học. Chỉ một số ít các nguyên tố, chẳng hạn như bạc và vàng, được tìm thấy dưới dạng chưa kết hợp với tư cách là các khoáng chất nguyên tố tự nhiên tương đối tinh khiết. Gần như tất cả các nguyên tố tự nhiên khác xuất hiện trong Trái đất dưới dạng hợp chất hoặc hỗn hợp. Không khí chủ yếu là hỗn hợp của các nguyên tố nitơ, oxy và argon, mặc dù nó có chứa các hợp chất bao gồm carbon dioxide và nước.
Lịch sử phát hiện và sử dụng các nguyên tố bắt đầu từ các xã hội loài người nguyên thủy phát hiện ra các khoáng chất bản địa như carbon, lưu huỳnh, đồng và vàng (mặc dù khái niệm về nguyên tố hóa học vẫn chưa được hiểu rõ). Nỗ lực phân loại các vật liệu như vậy đã dẫn đến các khái niệm về các nguyên tố cổ điển, thuật giả kim và nhiều lý thuyết tương tự khác nhau trong suốt lịch sử loài người. Phần lớn sự hiểu biết hiện đại về các nguyên tố được phát triển từ công trình của Dmitri Mendeleev, một nhà hóa học người Nga. Ông đã công bố bảng tuần hoàn dễ nhận biết đầu tiên vào năm 1869. Bảng này sắp xếp các nguyên tố theo số nguyên tử tăng dần thành các hàng (“chu kỳ”) trong đó các nguyên tố cùng cột (“nhóm”) có chung các tính chất vật lý và hóa học một cách tuần hoàn. Bảng tuần hoàn tóm tắt các tính chất khác nhau của các nguyên tố, cho phép các nhà hóa học suy ra mối quan hệ giữa chúng và đưa ra dự đoán về các hợp chất và các nguyên tố mới tiềm năng.
Đến tháng 11 năm 2016, Liên minh Hóa học Ứng dụng và Tinh khiết Quốc tế đã công nhận tổng số 118 nguyên tố. 94 nguyên tố đầu tiên xuất hiện tự nhiên trên Trái Đất, và 24 nguyên tố còn lại là các nguyên tố tổng hợp được tạo ra trong các phản ứng hạt nhân. Trừ ra các nguyên tố phóng xạ không ổn định (hạt nhân phóng xạ) phân hủy nhanh chóng, gần như tất cả các nguyên tố đều có sẵn trong công nghiệp với số lượng khác nhau. Việc khám phá và tổng hợp các nguyên tố mới hơn nữa là một lĩnh vực nghiên cứu khoa học đang diễn ra.
2. Bảng tuần hoàn nguyên tố hóa học là gì?
Bảng tuần hoàn (tên đầy đủ là Bảng tuần hoàn các nguyên tố hóa học, còn được biết với tên Bảng tuần hoàn Men-đê-lê-ép) là một phương pháp liệt kê các nguyên tố hóa học thành dạng bảng, dựa trên số hiệu nguyên tử (số proton trong hạt nhân), cấu hình electron và các tính chất hóa học tuần hoàn của chúng. Các nguyên tố được biểu diễn theo trật tự số hiệu nguyên tử tăng dần, thường liệt kê cùng với ký hiệu hóa học trong mỗi ô. Dạng tiêu chuẩn của bảng gồm các nguyên tố được sắp xếp thành 18 cột và 7 dòng, với hai dòng kép nằm riêng nằm bên dưới cùng.
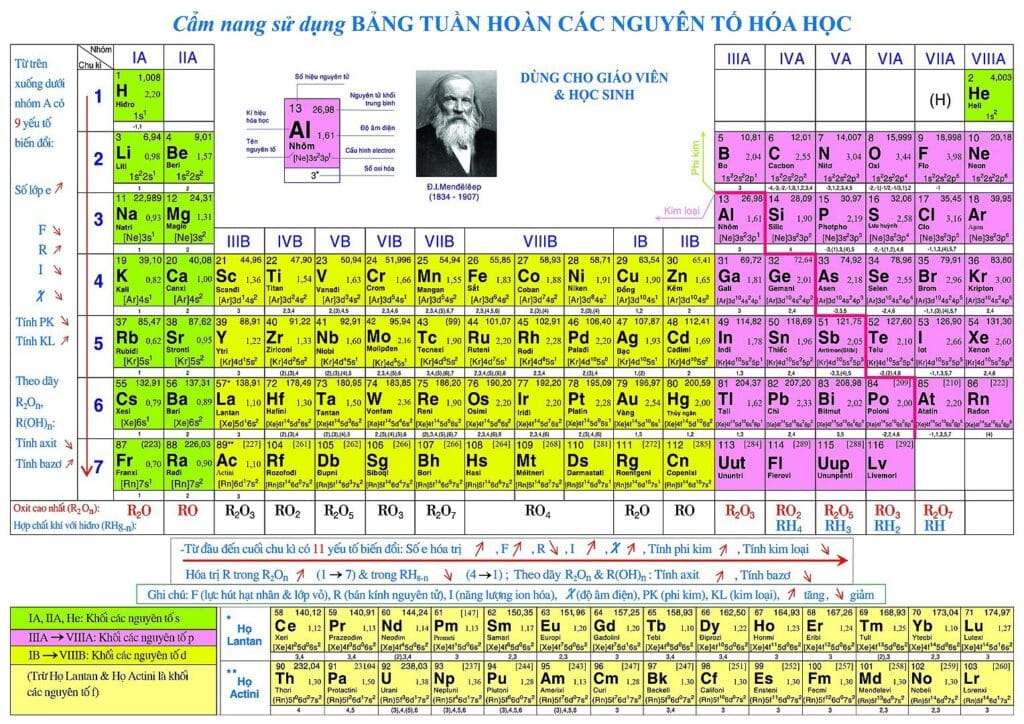
Các hàng trong bảng gọi là các chu kỳ, trong khi các cột gọi là các nhóm, một số có tên riêng như halogen hoặc khí hiếm. Bởi vì theo định nghĩa một bảng tuần hoàn thể hiện những xu hướng tuần hoàn, bất kỳ bảng dưới dạng nào cũng có thể dùng để suy ra mối quan hệ giữa các tính chất của nguyên tố và tiên đoán tính chất của những nguyên tố mới, chưa được khám phá hoặc chưa tổng hợp được. Do đó, một bảng tuần hoàn dù ở dạng tiêu chuẩn hay các biến thể cung cấp khuôn khổ hữu ích cho việc phân tích thuộc tính hóa học, và các bảng như vậy được sử dụng rộng rãi trong hóa học và các ngành khoa học khác.
Mặc dù có những người tiên phong trước đó, Dmitri Ivanovich Mendeleev thường được xem là người công bố bảng tuần hoàn phổ biến đầu tiên vào năm 1869. Ông đã phát triển bảng tuần hoàn của mình để minh họa các xu hướng tuần hoàn trong thuộc tính các nguyên tố đã biết khi đó. Mendeleev cũng tiên đoán một số thuộc tính của các nguyên tố chưa biết mà ông hi vọng sẽ lấp vào những chỗ trống trong bảng này. Hầu hết những tiên đoán của ông tỏ ra chính xác khi các nguyên tố đó lần lượt được phát hiện. Bảng tuần hoàn của Mendeleev từ đó đã được mở rộng và hiệu chỉnh với sự khám giá hoặc tổng hợp thêm những nguyên tố mới và sự phát triển của các mô hình lý thuyết để giải thích thuộc tính hóa học.
Tất cả các nguyên tố có số nguyên tử từ 1 (Hydro) đến 118 (oganesson) đã được phát hiện hoặc ghi nhận tổng hợp được, trong khi các nguyên tố 113, 115, 117 và 118 vẫn chưa được thừa nhận rộng rãi. 98 nguyên tố đầu tồn tại trong tự nhiên mặc dù một số chỉ tìm thấy sau khi đã tổng hợp được trong phòng thí nghiệm và tồn tại với lượng cực nhỏ. Các nguyên tố có số hiệu nguyên tử từ 99 đến 118 chỉ được tổng hợp ra, hoặc được tuyên bố là đã tổng hợp được trong phòng thí nghiệm. Người ta hiện vẫn đang theo đuổi việc tạo ra các nguyên tố có các số hiệu nguyên tử lớn hơn, cũng như tranh cãi về câu hỏi rằng bảng tuần hoàn có thể cần phải hiệu chỉnh ra sao để tương thích với những nguyên tố mới sẽ thêm vào.
3. Số nguyên tử là gì?
Số nguyên tử của một nguyên tố (ký hiệu Z) bằng số proton trong mỗi nguyên tử và xác định nguyên tố này.Ví dụ, tất cả các nguyên tử carbon đều chứa 6 proton trong hạt nhân nguyên tử của chúng; vậy số nguyên tử của carbon là 6. Nguyên tử carbon có thể có số neutron khác nhau; các nguyên tử của cùng một nguyên tố có số neutron khác nhau được gọi là các đồng vị của nguyên tố đó.
Số proton trong hạt nhân nguyên tử cũng quyết định điện tích của nó, do đó nó quyết định số electron của nguyên tử ở trạng thái không bị ion hóa. Các electron được đặt vào các obitan nguyên tử quyết định các tính chất hóa học khác nhau của nguyên tử. Số lượng neutron trong hạt nhân thường ảnh hưởng rất ít đến tính chất hóa học của nguyên tố (ngoại trừ trường hợp của hydro và đơteri). Do đó, tất cả các đồng vị carbon đều có các tính chất hóa học gần giống nhau vì chúng đều có 6 proton và 6 electron, mặc dù các nguyên tử carbon chẳng hạn có thể có 6 hoặc 8 neutron. Đó là lý do tại sao số nguyên tử, chứ không phải số khối hay trọng lượng nguyên tử, được coi là đặc điểm nhận dạng của một nguyên tố hóa học.
4. Đồng vị là gì?
Đồng vị là những nguyên tử của cùng một nguyên tố (nghĩa là có cùng số proton trong hạt nhân nguyên tử của chúng), nhưng có số neutron khác nhau. Vì vậy, chẳng hạn, có ba đồng vị chính của carbon. Tất cả các nguyên tử carbon đều có 6 proton trong hạt nhân, nhưng chúng có thể có 6, 7 hoặc 8 neutron. Vì số khối của chúng lần lượt là 12, 13 và 14, nên ba đồng vị của carbon được gọi là carbon-12, carbon-13 và carbon-14, thường được viết tắt là 12C, 13C và 14C. Carbon trong cuộc sống hàng ngày và trong hóa học là hỗn hợp của 12C (khoảng 98,9%), 13C (khoảng 1,1%) và khoảng 1 nguyên tử 14C trên một nghìn tỷ nguyên tử tổng cộng
Hầu hết (66 trong số 94) nguyên tố xuất hiện tự nhiên có nhiều hơn một đồng vị ổn định. Ngoại trừ các đồng vị của hydro (khác nhau rất nhiều về khối lượng tương đối – đủ để gây ra các hiệu ứng hóa học), các đồng vị của một nguyên tố nhất định gần như không thể phân biệt được về mặt hóa học.
Tất cả các nguyên tố đều có một số đồng vị là chất phóng xạ (đồng vị phóng xạ), mặc dù không phải tất cả các đồng vị phóng xạ này đều tồn tại ngoài tự nhiên. Các đồng vị phóng xạ thường phân rã thành các nguyên tố khác khi phóng ra một hạt alpha hoặc beta. Nếu một nguyên tố có các đồng vị không phóng xạ, chúng được gọi là cá đồng vị “ổn định”. Tất cả các đồng vị ổn định đã biết đều tồn tại ngoài tự nhiên (xem đồng vị nguyên thủy). Nhiều đồng vị phóng xạ không có trong tự nhiên đã được nghiên cứu sau khi được tạo ra một cách nhân tạo. Một số nguyên tố không có đồng vị bền và chỉ bao gồm các đồng vị phóng xạ: cụ thể là các nguyên tố không có đồng vị bền nào là techneti (số nguyên tử 43), promethi (số nguyên tử 61) và tất cả các nguyên tố quan sát được có số nguyên tử lớn hơn 82.
Trong số 80 nguyên tố có ít nhất một đồng vị bền, 26 nguyên tố chỉ có một đồng vị bền duy nhất. Số đồng vị ổn định trung bình của 80 nguyên tố ổn định là 3,1 đồng vị ổn định trên mỗi nguyên tố. Số lượng đồng vị bền lớn nhất xảy ra đối với một nguyên tố là 10 (thiếc, nguyên tố 50).
5. Khối lượng đồng vị và khối lượng nguyên tử
Số khối của một nguyên tố A, là số nucleon (proton và neutron) trong hạt nhân nguyên tử. Các đồng vị khác nhau của một nguyên tố nhất định được phân biệt bằng số khối của chúng, được viết theo quy ước dưới dạng ký tự trên bên trái của ký hiệu nguyên tử (ví dụ: 238U). Số khối luôn là một số nguyên và có đơn vị là “nucleon”. Ví dụ, magnesi-24 (24 là số khối) là một nguyên tử có 24 nucleon (12 proton và 12 neutron).
Trong khi số khối chỉ đơn giản đếm tổng số neutron và proton và do đó là một số tự nhiên, khối lượng nguyên tử của một nguyên tử là một số thực cho khối lượng của một đồng vị cụ thể (hoặc “nuclide”) của nguyên tố, tính bằng đơn vị khối lượng nguyên tử (kí hiệu: u). Nói chung, số khối của một nuclide nhất định khác một chút về giá trị so với khối lượng nguyên tử của nó, vì khối lượng của mỗi proton và neutron không chính xác đúng 1 u; vì các điện tử đóng góp một phần nhỏ hơn vào khối lượng nguyên tử vì số neutron vượt quá số proton; và (cuối cùng) vì năng lượng liên kết hạt nhân. Ví dụ, khối lượng nguyên tử của chlor-35 có năm chữ số có nghĩa là 34,969 u và của chlor-37 là 36,966 u. Tuy nhiên, khối lượng nguyên tử tính bằng u của mỗi đồng vị khá gần với số khối lượng đơn giản của nó (luôn nằm trong khoảng 1%). Đồng vị duy nhất có khối lượng nguyên tử chính xác là một số tự nhiên là 12C, theo định nghĩa có khối lượng chính xác bằng 12 vì u được định nghĩa là 1/12 khối lượng của nguyên tử carbon-12 trung hòa tự do ở trạng thái cơ bản.
Trọng lượng nguyên tử tiêu chuẩn (thường được gọi là “trọng lượng nguyên tử”) của một nguyên tố là trung bình cộng của các khối lượng nguyên tử của tất cả các đồng vị của nguyên tố hóa học được tìm thấy trong một môi trường cụ thể, có trọng lượng bằng lượng đồng vị, so với đơn vị khối lượng nguyên tử. Số này có thể là một phân số không gần với một số nguyên. Ví dụ, khối lượng nguyên tử tương đối của chlor là 35,453 u, khác rất nhiều so với một số nguyên vì nó là trung bình của khoảng 76% chlor-35 và 24% chlor-37. Bất cứ khi nào giá trị khối lượng nguyên tử tương đối khác hơn 1% so với một số nguyên, đó là do hiệu ứng trung bình này, vì một lượng đáng kể của nhiều hơn một đồng vị có trong một mẫu nguyên tố đó một cách tự nhiên.
6. Bảng ký hiệu nguyên tố hóa học
| Symbol | Name | Pronunciation |
|---|---|---|
| Ac | Actinium | /ækt'ɪnɪəm/ |
| Ag | Silver | /'sɪlvə/ |
| Al | Aluminium | /æljʊ'mɪnɪəm/ |
| Am | Americium | /əmə'risɪəm/ |
| Ar | Argon | /'ɑːgɒn/ |
| As | Arsenic | /’ɑːsnɪk/ |
| At | Astatine | /'æstəti:n/ |
| Au | Gold | /'gəʊld/ |
| B | Boron | /'bɔːrɒn/ |
| Ba | Barium | /ˈbəɛrɪəm/ |
| Be | Beryllium | /bəˈrɪlɪəm/ |
| Bh | Bohrium | ˈbɔ:rɪəm/ |
| Bi | Bismuth | /ˈbɪzməθ/ |
| Bk | Berkelium | /ˈbɜ:klɪəm/ |
| Br | Bromine | /ˈbrəʊmiːn/ |
| C | Carbon | /ˈkɑ:bən/ |
| Ca | Calcium | /ˈkælsɪəm/ |
| Cd | Cadmium | /ˈkælmɪəm/ |
| Ce | Cerium | /ˈsi:rɪəm/ |
| Cf | Californium | /kælɪˈfɔ:nɪəm/ |
| Cl | Chlorine | /ˈklɔ:riːn/ |
| Cm | Curium | /ˈkjuːrɪəm/ |
| Co | Cobalt | /ˈkəʊbɒlt/ |
| Cr | Chromium | /ˈkrəʊmɪəm/ |
| Cs | Caesium | /ˈsiːzɪəm/ |
| Cu | Copper | /ˈkɒpə/ |
| Db | Dubnium | /ˈdʌbnɪəm/ |
| Ds | Darmstadtium | /dɑ:mˈstætɪəm/ |
| Dy | Dysprosium | /dɪsˈprəʊzɪəm/ |
| Er | Erbium | /ˈɜ:bɪəm/ |
| Es | Einsteinium | /aɪnˈstaɪnɪəm/ |
| Eu | Europium | /ju:ˈrəʊpɪəm/ |
| F | Fluorine | /ˈflʊəriːn/ |
| Fe | Iron | /ˈaɪən/ |
| Fm | Fermium | /ˈfɜ:mɪəm/ |
| Fr | Francium | /ˈfrænsɪəm/ |
| Ga | Gallium | /ˈgælɪəm/ |
| Gd | Gadolinium | /gædəˈlɪnɪəm/ |
| Ge | Germanium | /dʒəˈmeɪnɪəm/ |
| H | Hydrogen | /ˈhaɪdrəʤən/ |
| He | Helium | /ˈhi:lɪəm/ |
| Hf | Hafnium | /ˈhæfnɪəm/ |
| Hg | Mercury | /ˈmɜ:kjʊrɪ/ |
| Ho | Holmium | /ˈhəʊlmɪəm/ |
| Hs | Hassium | /ˈhæsɪəm/ |
| I | Iodine | /ˈaɪədiːn/ |
| In | Indium | /ˈɪndɪəm/ |
| Ir | Iridium | /ɪˈrɪdɪəm/ |
| K | Potassium | /pəˈtæsɪəm/ |
| Kr | Krypton | /ˈkrɪptən/ |
| La | Lanthanum | /ˈlænθənəm/ |
| Li | Lithium | /ˈlɪθɪəm/ |
| Lr | Lawrencium | /ləˈrensɪəm/ |
| Lu | Lutetium | /ljuːˈtiːʃəm/ |
| Md | Mendelevium | /mendəˈlɪvɪəm/ |
| Mg | Magnesium | /mægˈniːzɪəm/ |
| Mn | Manganese | /ˈmæŋgəniːz/ |
| Mo | Molybdenum | /məˈlɪbdənəm/ |
| Mt | Meitnerium | /maɪtˈnɜ:rɪəm/ |
| N | Nitrogen | /ˈnaɪtrədʒən/ |
| Na | Sodium | /ˈsəʊdɪəm/ |
| Nb | Niobium | /naɪˈəʊbɪəm/ |
| Nd | Neodymium | /niːəʊˈdɪmɪəm/ |
| Ne | Neon | /ˈniːɒn/ |
| Ni | Nickel | /ˈnɪkəl/ |
| No | Nobelium | /nəʊˈbiːlɪəm/ |
| Np | Neptunium | /nepˈtjuːnɪəm/ |
| O | Oxygen | /ˈɒksɪdʒən/ |
| Os | Osmium | /ˈɒzmɪəm/ |
| P | Phosphorus | /ˈfɒsfərəs/ |
| Pa | Protactinium | /prəʊtækˈtɪnɪəm/ |
| Pb | Lead | /ˈled/ |
| Pd | Palladium | /pəˈleɪdɪəm/ |
| Pm | Promethium | /prəˈmiːθɪəm/ |
| Po | Polonium | /pəˈləʊnɪəm/ |
| Pr | Praseodymium | /preɪzɪəʊˈdɪmɪəm/ |
| Pt | Platinum | /ˈplætɪnəm/ |
| Pu | Plutonium | /pluːˈtəʊnɪəm/ |
| Ra | Radium | /ˈreɪdɪəm/ |
| Rb | Rubidium | /ruːˈbɪdɪəm/ |
| Re | Rhenium | /ˈriːnɪəm/ |
| Rf | Rutherfordium | /rʌðəˈfɔ:dɪəm/ |
| Rg | Roentgenium | /rɒntˈgenɪəm/ |
| Rh | Rhodium | /ˈrəʊdɪəm/ |
| Rn | Radon | /ˈreɪdɒn/ |
| Ru | Ruthenium | /ruːˈθiːnɪəm/ |
| S | Sulphur | /ˈsʌlfə/ |
| Sb | Antimony | /'æntɪmənɪ/ |
| Sc | Scandium | /ˈskændɪəm/ |
| Se | Selenium | /səˈliːnɪəm/ |
| Sg | Seaborgium | /siːˈbɔ:gɪəm/ |
| Si | Silicon | /ˈsɪlɪkən/ |
| Sm | Samarium | /səˈmɛərɪəm/ |
| Sn | Tin | /ˈtɪn/ |
| Sr | Strontium | /ˈstrɒntɪəm/ |
| Ta | Tantalum | /ˈtæntələm/ |
| Tb | Terbium | /ˈtɜ:bɪəm/ |
| Tc | Technetium | /tekˈniːʃɪəm/ |
| Te | Tellurium | /təˈlʊərɪəm/ |
| Th | Thorium | /ˈθɔ:rɪəm/ |
| Ti | Titanium | /tɪˈteɪnɪəm/ |
| Tl | Thallium | /ˈθælɪəm/ |
| Tm | Thulium | /ˈθjuːlɪəm/ |
| U | Uranium | /jʊˈreɪnɪəm/ |
| Uub | Ununbium | /juːˈnʌnbɪəm/ |
| Uuh | Ununhexium | /ˌjuːnənˈheksɪəm/ |
| Uuo | Ununoctium | ˌ/juːnəˈnɒktɪəm/ |
| Uup | Ununpentium | /juːnənˈpentɪəm/ |
| Uuq | Ununquadium | /juːnənˈkwɒdɪəm/ |
| Uut | Ununtrium | /juːˈnʌntrɪəm/ |
| V | Vanadium | /vəˈneɪdɪəm/ |
| W | Tungsten | /ˈtʌŋstən/ |
| Xe | Xenon | /ˈzenɒn/ |
| Y | Yttrium | /ˈɪtrɪəm/ |
| Yb | Ytterbium | /ɪˈtɜːbɪəm/ |
| Zn | Zinc | /ˈzɪŋk/ |
| Zr | Zirconium | /zɜːˈkəʊnɪəm/ |
7. Các công thức hóa học thường gặp
| Symbol | Name |
|---|---|
| CO2 | Carbon dioxide |
| CO | Carbon monoxide |
| NO2 | Nitrogen dioxide |
| N2O | Dinitrogen oxide |
| NO | Nitrogen oxide |
| N2O4 | Dinitrogen tetroxide |
| SO2 | Sulphur dioxide |
| SO3 | Sulphur trioxide |
| H2SO4 | Suphuric acid |
| HCl | Hydrochloric acid |
| HNO3 | Nitric acid |
| PCl5 | Phosphorus pentachloride |
Kết luận:
Bảng tuần hoàn nguyên tố hóa học không chỉ là một công cụ quan trọng trong nghiên cứu và giảng dạy hóa học, mà còn phản ánh cấu trúc và tính chất của các nguyên tố. Nó giúp chúng ta hiểu được mối quan hệ giữa các nguyên tố, dự đoán tính chất của các hợp chất và hướng dẫn trong việc phát triển các ứng dụng công nghệ mới. Việc nắm vững bảng tuần hoàn là nền tảng cho bất kỳ ai muốn khám phá sâu hơn về thế giới hóa học và các nguyên tắc điều khiển nó.
Theo Wiki
