Phụ thuộc vào điều kiện (nhiệt độ, áp suất,…) và tương tác giữa các phần tử cấu thành (lực liên kết giữa các phân tử, nguyên tử). Vật chất có thể tồn tại ở trạng thái rắn, lỏng hoặc khí (hơi). Tính chất của vật rắn (vật liệu) phụ thuộc chủ yếu vào cách sắp xếp của các phần tử cấu thành và lực liên kết giữa chúng.
1. Cấu tạo nguyên tử và các liên kết điển hình trong chất rắn
Mô hình cấu tạo nguyên tử
Nguyên tử là một hệ thống bao gồm hạt nhân mang điện tích dương (+) và các điện tử bao quanh mang điện tích âm (-) chuyển động xung quanh. Hạt nhân nguyên tử cấu tạo bởi các Proton (prôtron) và Neutron (nơtron). Proton mang điện dương có điện tích bằng điện tích của điện tử, neutron không mang điện. Trong trạng thái bình thường nguyên tử trung hòa điện vì số lượng proton bằng số lượng điện tử. Số này được đặc trưng bằng số thứ tự (Z) trong bảng tuần hoàn Mendeleev.
Khối lượng nguyên tử bằng khối lượng hạt nhân của nó vì khối lượng proton và neutron lớn hơn rất nhiều so với khối lượng điện tử. Với cùng khối lượng điện tử và proton, hạt nhân có thể chứa số neutron khác nhau và tạo nên các đồng vị của cùng một nguyên tố hóa học.
Cấu hình điện tử (electron configuration) chỉ rõ: số lượng tử chính (1,2,3,…), ký hiệu phân lớp (s,p,d,…), số lượng tử thuộc phân lớp (số mũ trên ký hiệu phân lớp).
Ví dụ: Cu có Z = 29 có cấu hình điện tử là 1s2 2s2 2p6 3s2 3p6 3d10 4s1 qua đó biết được số điện tử ngoài cùng (ở đây là 1, hóa trị 1)
Trong số kim loại có nhóm kim loại chuyển tiếp là loại có phân lớp ở sát phân lớp ngoài cùng bị thiếu điện tử.
Ví dụ: Fe có Z = 26 có cấu hình điện tử là 1s2 2s2 2p6 3s2 3p6 3d6 4s2 (trong trường hợp này phân lớp 3d bị thiếu, chỉ có 6, nếu đủ phải là 10 như trường hợp của Cu)
Điện tử vẫn có thể chuyển từ mức năng lượng này sang mức năng lượng khác (thuộc lớp hoặc phân lớp). Khi đó chúng sẽ phát ra hoặc thu vào một năng lượng dưới dạng lượng tử ánh sáng
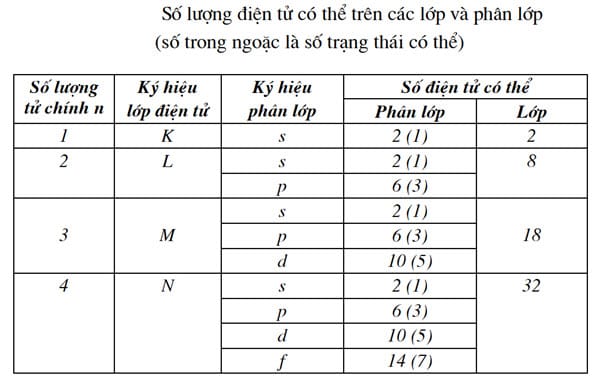
Theo số lượng tử chính n ta có bảng số lượng điện tử có thể (số trạng thái năng lượng) trên một số lớp và phân lớp như sau:
- 1s – K
- 2s 2p – L
- 3s 3p 3d – M
- 4s 4p 4d 4f – N
Các loại liên kết nguyên tử thường gặp
Trong chất rắn thường gặp 5 loại liên kết sau đây: liên kết đồng hóa trị, liên kết ion, liên kết kim loại, liên kết hỗn hợp và liên kết Vanderval
a. Liên kết đồng hóa trị
Liên kết này tạo ra khi 2 (hoặc nhiều) nguyên tử góp chung một số điện tử hóa trị để có đủ tám điện tử ở lớp ngoài cùng (điện tử hóa trị)
Đặc điểm của liên kết đồng hóa trị:
- Liên kết có tính định hướng, nghĩa là xác suất tồn tại các điện tử liên kết lớn nhất theo phương nối tâm các nguyên tử
- Cường độ liên kết phụ thuộc rất mạnh vào đặc tính liên kết giữa các điện tử hóa trị hạt nhân. Ví dụ Carbon ở dạng đa hình kim cương có liên kết đồng hóa trị rất mạnh vì 4 điện tử hóa trị (trong 6 điện tử) liên kết hầu như trực tiếp với hạt nhân. Do vậy nhiệt độ nóng chảy của nó cao hơn 3550°C. Trong khi đó Thiếc (Sn) có liên kết đồng hóa trị rất yếu vì 4 điện tử hóa trị (trong số 50 điện tử) nằm xa hạt nhât nên lực liên kết yếu đối với hạt nhân do đó nhiệt độ nóng chảy thấp 270°C
- Liên kết đồng hóa trị có thể xảy ra giữa các nguyên tử cùng loại (của một nguyên tố hóa học trong các nhóm từ IVA đến VIIA), gọi là liên kết đồng hóa trị đồng cực. Ví dụ trong phân tử Cl2 hay các tinh thể kim cương, Silic, Giecmani,… Liên kết đồng hóa trị giữa các nguyên tử khác loại (các nguyên tố hóa học nhóm IIIA với nhóm VIA) gọi là liên kết đồng hóa trị dị cực
Các ví dụ minh họa:
- Clo có 7 điện tử ở lớp ngoài cùng, mỗi nguyên tử góp chung một điện tử nên một phân tử gồm 2 nguyên tử Clo sẽ chung nhau 2 điện tử làm cho lớp điện tử ngoài cùng của nguyên tử nào cũng đủ 8
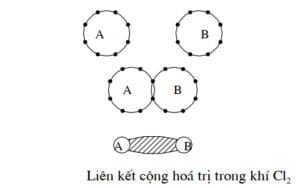
- Giecmani (Ge) có 4 điện tử ở lớp ngoài cùng (4s2, 4p2), mỗi nguyên tử góp chung 1 điện tử, nên một nguyên tử đã cho cần có 4 nguyên tử xung quanh để tạo nên cấu trúc bền vững với 8 điện tử. Liên kết đồng hóa trị xảy ra giữa các nguyên tử cùng loại (của nguyên tố hóa học trong các nhóm từ IVB, VIIB như Cl, Ge) là loại đồng cực, còn giữa các nguyên tố khác loại như CH4 là loại dị cực
- Metan (CH4) Carbon chỉ có 4 điện tử ở lớp ngoài cùng như vậy nó thiếu tới 4 điện tử để đủ 8. Trong trường hợp này nó sẽ kết hợp với 4 nguyên tử Hydro để mỗi nguyên tử nafygops cho nó một điện tử làm cho lớp điện tử ngoài cùng đủ 8. Đó là bản chất lực liên kết trong phân tử Metan (CH4)
Nói chung liên kết đồng hóa trị là liên kết mạnh, tuy nhiên cường độ của nó phụ thuộc rất nhiều vào đặc tính liên kết giữa điện tử hóa trị với hạt nhân.
b. Liên kết ion
Đây là loại liên kết mạnh, các nguyên tử cho bớt điện tử lớp ngoài cùng và trở thành ion dương hay nhận thêm điện tử để bão hòa lớp ngoài cùng và trở thành ion âm. Ví dụ: trong liên kết LiF, Li cho bớt một điện tử lớp ngoài cùng trở thành Li+, còn F nhận thêm một điện tử và trở hành F–
Liên kết ion thường tạo nên giữa các nguyên tố có nhiều điện tử hóa trị (nhóm VIB, VIIB) với các nhóm nguyên tố có ít điện tử hóa trị (nhóm IB, IIB). Liên kết ionCác oxit kim loại như Al2O3, MgO, CaO, Fe3O4, NiO,… có xu thế mạnh với tạo liên kết ion
Liên kết ion càng bền vững (càng mạnh) khi các nguyên tử chứa càng ít điện tử, nghĩa là các điện tử cho và nhận nằm gần hạt nhân. Liên kết ion là loại liên kết không định hướng. Ví dụ Hydro tạo với F, Cl, Br, I các hợp chất HF, HCl, HBr, HI có năng lượng liên kết lần lượt 5,81 eV/mol; 4,44 eV/mol; 3,75 eV/mol; và 3,06 eV/mol;
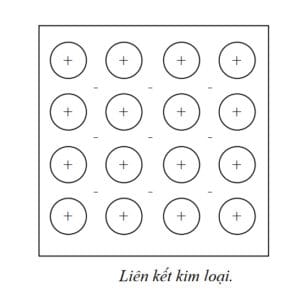
c. Liên kết kim loại
Các ion dương kim loại tạo thành mạng xác định, đặt trong không gian điện tử tự do chung. Năng lượng liên kết là tổng hợp (cân bằng) của lực hút (giữa ion dương và điện tử tự do bao quanh) và lực đẩy (giữa các ion dương), chính nhờ sự cân bằng này mà các nguyên tử, ion kim loại luôn luôn có vị trí cân bằng xác định trong đám mây điện tử.
Liên kết kim loại thường được tạo nên từ những nguyên tử có ít điện tử hóa tri, chúng liên kết yếu với hạt nhân dễ dàng bứt ra khỏi nguyên tử trở nên tự do (không bị ràng buộc bởi nguyên tử nào) và tạo nên “mây” hay “biển” điện tử.
Ví dụ: các nguyên tử ở nhóm IA trong bảng tuần hoàn Mendeleev với một điện tử hóa trị có tính kim loại điển hình. Càng đi về bên phải của bảng tuần hoàn tính chất đòng hóa trị trong liên kết càng cao. Các chất rắn có liên kết kim loại trong cấu trúc tinh thể của nó có tính đối xứng cao
Các liên kết đặc trưng tạo cho các vật liệu kim loại có các tính chất điển hình rất đặc trưng và được gọi là tính kim loại, bao gồm:
- Ánh kim hay vẻ sáng: Bề mặt kim loại (khi chưa bị oxy hóa) sáng khi bị ánh sáng chiếu vào, điện tử tự do nhận năng lượng và bị kích thước, có mức năng lượng cao hơn song không ổn định, khi trở về mức cũ sẽ phát ra sóng ánh sáng
- Dẫn nhiệt và dẫn điện cao: Nhờ có điện tử tự do rất dễ chuyển động định hướng dưới một hiệu điện thế làm kim loại có tính dẫn điện cao. Tính dẫn nhiệt cao được giải thích bằng sự truyền động năng của các điện tử tự do và ion dương
- Tính dẻo cao: Đây là đặc tính rất có giá trị, nhờ có nó mà kim loại có thể cán, dát mỏng thành tấm, lá, màng, cán kéo thành thanh, sợi, dây rất thuận tiện cho vận chuyển, gia công và sử dụng.
- Ở một số kim loại có thêm độ bền tốt và cao đã được sử fungj rộng rãi trong các kết cấu vừa chịu tải tốt lại khó gãy, vỡ đột ngột.
- Sự có mặt của điện tử tự do hay mây điện tử cũng là nguyên nhân của tính dẻo cao.
- Các ion dương kim loại rất dễ dịch chuyển giữa các lớp đệm là mây điện tử dưới tác dụng cơ học, hơn nữa khi kim loại bị biến hình (tức các in chuyển chỗ) liên kết kim loại vẫ được bảo tồn do vị trí tương quan giữa các ion dương và điện tử tự do không thay đổi. Đây là điều mà các loại liên kết khác không có được nên tính dẻo thấp
- Kim loại có cấu tạo mạng đơn giản và xít chặt, trong đó các mặt tinh thể có mật độ chênh lệch nhau rõ ràng, nhờ đó các mặt dày đặc hơn có lên kết bền chắc hơn, dễ trượt lên nhau dưới tác dụng cơ học
Tuy nhiên không phải mọi kim loại đều có các đặc tính trên, song các kim loại thông dụng (sắt, nhôm, đồng,…) đều có đặc tính như trên rất rõ rệt.
d. Liên kết hỗn hợp
Liên kết đồng hóa trị thuần túy chỉ có được trong trường hợp liên kết đồng cực (giữa các nguyên tử của cùng một nguyên tố hóa học). Trong trường hợp liên kết dị cực (giữa các nguyên tử của các nguyên tố khác nhau) điện tử háo trị tham gia liên kết chịu 2 ảnh hưởng trái ngược:
- Bị hút bởi hạt nhân của nó
- Bị hút bởi hạt nhân của nguyên tử thứ 2 để tạo điện tử chung
Bên dưới là bảng tuần hoàn các nguyên tố hóa học và mạng tinh thể của chúng
Khả năng của hạt nhân hút điện tử hóa trị được gọi là tính âm của nguyên tử. Sự khác nhau về tính âm điện giữa các nguyên tử trong liên kết đồng hóa trị làm đám mây điện tử “chung” bị biến dạng và tạo thành ngẫu cực điện, đó là tiền tố của liên kết ion. Tính ion của liên kết sẽ càng lớn nếu sự khác nhau về tính âm điện của các nguyên tử càng lớn
Ví dụ: Na có tính âm điện bằng 0,9 còn Cl có tính âm điện bằng 3,0. Do vậy trong liên kết NaCl gồm khoảng 58% liên kết ion và 48% liên kết đồng hóa trị. Tất cả những liên kết dị cực đều mang tính chất hỗn hợp giữa liên kết ion và đồng hóa trị
e. Liên kết Vanderval
Liên kết đồng hóa trị cho phép giải thích sự tạo thành các phân tử nước như (H2O) hay polyetylen (C2H4)n nhưng không thể giải thích sự tạo thành một số vật rắn từ phân tử trung hòa như nước đá, polyme
Trong nhiều phân tử có liên kết đồng hóa trị, do sự khác nhau về tính âm điện của các nguyên tử, trọng tâm điện tích dương và điện tích âm không trùng nhau sẽ tạo thành ngẫu cực điện và phân tử bị phân cực. Liên kết Valderval là liên kết do hiện tượng hút nhau giữa các nguyên tử hoặc phân tử bị phân cực ở trạng thái rắn. Đây là loại liên kết yếu, rất dễ bị phá hủy khi tăng nhiệt độ. Do vậy các chất rắn trên cơ sở liên kết Valderval có nhiệt độ nóng chảy thấp. Ví dụ: nước đá nóng chảy ở 0°C
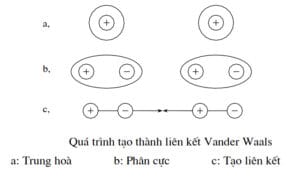
Năng lượng liên kết:
\[U = – \frac{A}{{{r^6}}}\]
Lực liên kết:
\[F = – \frac{B}{{{r^7}}}\]
2. Cấu tạo mạng tinh thể lý tưởng
Các vật rắn trong tự nhiên được phân thành 2 nhóm là vật rắn tinh thể và vật vô định. Việc phân loại này để tạo sự thuận lợi cho quá trình mô hình hóa khi nghiên cứu vật liệu. Các vật liệu kim loại là loại vật liệu kết cấu cơ bản hiện nay chủ yếu là các vật có cấu tạo tinh thể.
2.1. Vật tinh thể và vật vô định là gì?
Theo quan điểm của vật lý chất rắn, các vật rắn được gọi là tinh thể khi chúng đồng thỏa mãn các điều kiện sau:
- Là những vật luôn tồn tại với một hình dáng xác định trong không gian, hình dáng bên ngoài của chúng thể hiện một phần các tính chất bên trong
- Vật tinh thể luôn luôn tồn tại một nhiệt độ nóng chảy (hoặc kết tinh) xác định. Có nghĩa là khi nung nóng vật tinh thể luôn có một nhiệt độ chuyển biến từ trạng thái rắn sang trạng thái lỏng xác định. Điều này cũng đúng khi làm nguội vật tinh thể từ thể lỏng
- Vật tinh thể khi bị đập gãy (phá hủy), sẽ bị gãy theo các mặt xác định và bề mặt vết gãy không nhẵn bóng. Tính chất này thể hiện rõ rệt sự khác biệt về tính chất của vật tinh thể với vật vô định hình.
- Vật tinh thể luôn có tính dị hướng, có nghĩa là tính chất của nó (cơ, lý, hóa tính) theo các phương khác nhau luôn có sự khác biệt. Điều này thể hiện rõ sự sắp xếp các nguyên tử trong vật tinh thể là tuân theo một quy luật xác định.
Ngược lại với vật tinh thể là các vật vô định hình. Vật vô định hình là những vật không tồn tại một hình dạng xác định trong không gian (có hình dáng là của vật chứa nó). Không có nhiệt độ nóng chảy hoặc kết tinh xác định, không thể hiện tính dị hướng…Một số vật vô định hình tiêu biểu như nhựa đường, parafin, thủy tinh.
Tuy nhiên việc phân biệt rõ ràng và rạch ròi giữa vật tinh thể và vô định hình là mang tính tương đối. Với sự phát triển của vật lý hiện đại, ranh giới giữa vật tinh thể và vật vô định hình trở nên không rõ ràng, ví dụ với vật liệu kim loại tiến hành nguội nhanh với tốc độ nguội rất lớn (đến hàng triệu °C/s) ta thu được kim loại có độ hạt rất nhỏ và thể hiện cả tính chất của vật vô định hình.
2.2. Cấu tạo tinh thể lý tưởng
Mạng tinh thể là mô hình không gian, dùng để nghiên cứu quy luật sắp xếp của nguyên tử (hoặc ion, phân tử) trong vật tinh thể. Từ mô hình này cho phép chúng ta xác định được các đặc trưng cơ bản, định hướng được tính chất của các vật liệu sử dụng. Như vậy để xây dựng mô hình mạng tinh thể, bạn cần phải xác định được hệ tọa độ và đơn vị đo khi xây dựng mạng tinh thể.
Mặt tinh thể là gì ?
Trong kim loại các nguyên tử sắp xếp có trật tự, tức là chúng đều nằm trên những mặt phẳng song song và cách đều nhau gọi là mặt tinh thể. Tập hợp vô số các mặt như vật tạo nên mạng tinh thể
Phương pháp xây dựng mạng tinh thể:
Để xây dựng mô hình mạng tinh thể đầu tiên bạn cần chọn một nguyên tử (ion, phân tử) bất kỳ (từ đây gọi là chất điểm) làm gốc. Từ chất điểm gốc bạn kẻ ba trục tọa độ qua ba chất điểm gần nhất (không cùng một mặt phẳng) làm ba trục tọa độ. Như vậy trên mỗi trục tọa độ của hệ trục tọa độ Decarte thu được sẽ có hàng loạt các chất điểm cách đều nhau. Qua các chất điểm đó ta dựng các đường thẳng song song với các trục tọa độ. Các đường thẳng đó cắt nhau tạo thành mô hình mạng tinh thể.
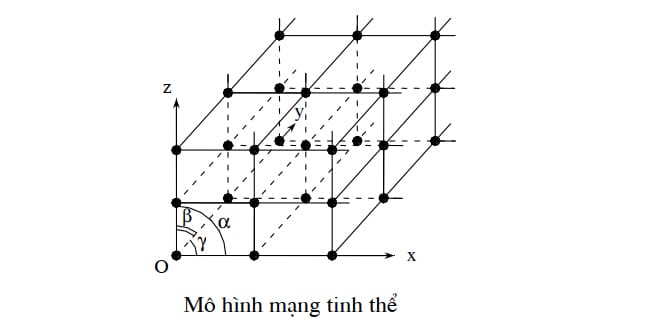
Với mô hình mạng tinh thể như vậy, bạn có thể thấy để xác định một vị trí bất kỳ trong mạng tinh thể, ta có vector định vị là
\[{\vec r_n} = m.\vec a + n.\vec b + j.\vec c\]
Trong đó:
- \(\vec a\): Vetor đơn vị theo trục Ox, có trị số bằng khoảng cách giữa 2 chất điểm gần nhất theo trục Ox
- \(\vec b\): Vector đơn vị theo trục Oy
- \(\vec c\): Vector đơn vị theo trục Oz
- m, n, j: Chỉ số theo ba trục tọa độ Ox, Oy, Oz
Như vậy một mô hình mạng tinh thể sẽ được xác định khi chúng ta có bộ 6 thông số là ba vector đơn vị \(\vec a\), \(\vec b\), \(\vec c\) và ba góc α (zOx, yOx), β (zOy, yOx), γ (zOy, zOx). Từ cách xây dựng như trên, bạn có thể thấy mạng tinh thể có các tính chất cơ bản sau:
– Mạng tinh thể là vô tận, không tồn tại khái niệm kích thước mạng, mà chỉ có giá trị xác định là các vector đơn vị và các góc định vị (do số lượng nguyên tử trong vật rắn là vô hạn)
– Khi dịch chuyển mạng tinh thể đi một khoảng cách bằng khoảng cách giữ 2 chất điểm theo phương nối 2 chất điểm đó, mạng tự trùng lặp với chính mình. Khoảng cách đó gọi là chu kỳ lặp của mạng. Nếu khoảng cách đó được đo theo các trục tọa độ thì được gọi là chu kỳ mạng hay thông số mạng.
– Mạng tinh thể là mô hình không gian, tồn tại nhiều yếu tố đối xứng khác nhau.
– Tùy thuộc vào bộ các thông số xác định mạng tinh thể (\(\vec a\), \(\vec b\), \(\vec c\), α, β, γ) chúng ta có các kiểu mạng khác nhau và do đó có các quy luật sắp xếp chất điểm khác nhau
Mạng tinh thể lý tưởng là mạng mà đáp ứng hoàn hảo các quy luật sắp xếp của chất điểm tại các vị trí, xác suất bắt gặp chất điểm bằng một, các chất điểm hoàn toàn giống nhau về kích thước và bản chất
Như vậy khi xây dựng mạng tinh thể cho một vật rắn bất kỳ, bạn sẽ có một môt hình không gian vô tận, về sự sắp xếp của các chất điểm. Việc nghiên cứu trên toàn bộ mạng là khó khăn và không cần thiết. Chính vì vậy để thuận lợi cho nghiên cứu tinh thể, người ta tiến hành nghiên cứu từ các phần tử nhỏ nhất cấu tạo nên mạng tinh thể đó là các ô cơ bản
Ô cơ bản (cơ sở) trong mạng tinh thể là gì
Ô cơ bản là phần nhỏ nhất đặc trưng cho một loại mạng tinh thể. Có thể xem như mạng tinh thể là do vô số các khối cơ sở xếp liên tiếp tạo nên
Do không thể biể diễn cả mạng tinh thể với vô vàn nguyên tử. Trong cả mạng tinh thể với các chất điểm (ion, nguyên tử, phân tử) sắp xếp theo trật tự, có quy luật đó bao giờ cũng tìm được hình không gian nhỏ nhất đặc trưng cho quy luật sắp xếp đó được gọi là ô cơ sở.
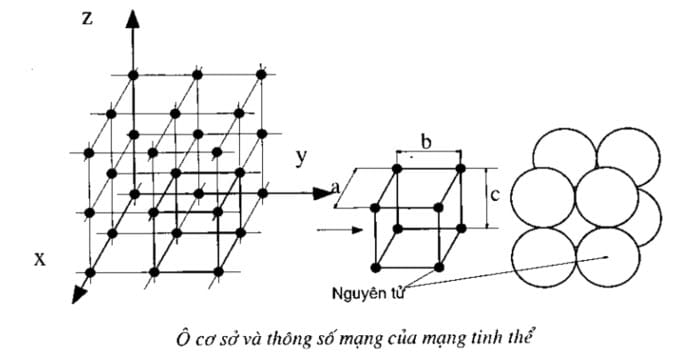
Ô cơ sở được xây dựng trên 3 vector đơn vị \(\vec a\), \(\vec b\), \(\vec c\) tương ứng 3 trục tọa độ Ox, Oy, Oz. Tâm các nguyên tử (ion hoặc phân tử) ở đỉnh ô là các nút mạng. Module của 3 vector đó a, b, c là kích thước của ô cơ sở còn gọi là hằng số mạng hay thông số mạng hay chu kỳ tuần hoàn (chu kỳ tịnh tiến) của mạng tinh thể theo ba chiều tương ứng. Các góc tạo bởi ba vector \(\vec a\), \(\vec b\), \(\vec c\), khi hợp từng đôi một ký hiệu là α, β, γ (α là góc giữa vector b và c, β là góc giữa vector a và c, còn γ là góc giữa vector a và b)
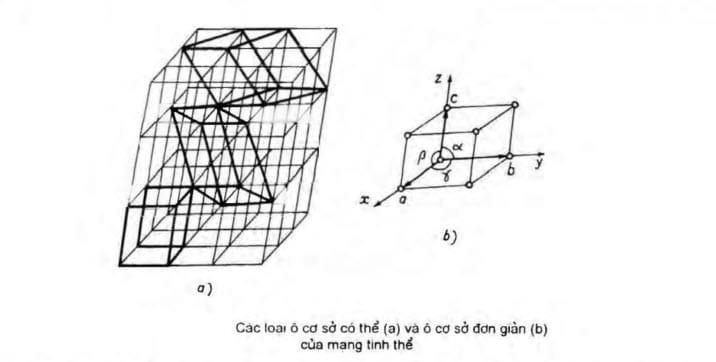
Trong cùng mạng tinh thể, có thể chọn được nhiều kiểu ô cơ sở khác nhau như hình trên. Tuy nhiên vì ô cơ sở là đơn vị tuần hoàn nhỏ nhất của mạng tinh thể cho nên việc lựa chọn phải thỏa mãn nguyên tắc sao cho nó đại diện đầy đủ cho tính chất và cấu trúc của toạn bộ tinh thể. Các nguyên tắc đó là:
- Tính chất đối xứng của ô cơ sở phải là tính đối xứng của tinh thể (về hình dáng bên ngoài và các tính chất)
- Số cạnh bằng nhau và số góc (giữa các cạnh) bằng nhau của ô phải nhiều nhất
- Nếu có các góc vuông giữa các cạnh thì số góc đó phải nhiều nhất
- Có thể tích nhỏ nhất hoặc cạnh bên ngắn nhất
Ô cơ sở có thể tích nhỏ nhất và chỉ có tám nguyên tử (ion, phân tử) nằm ở đỉnh (nút mạng) gọi là ô cơ sở đơn giản
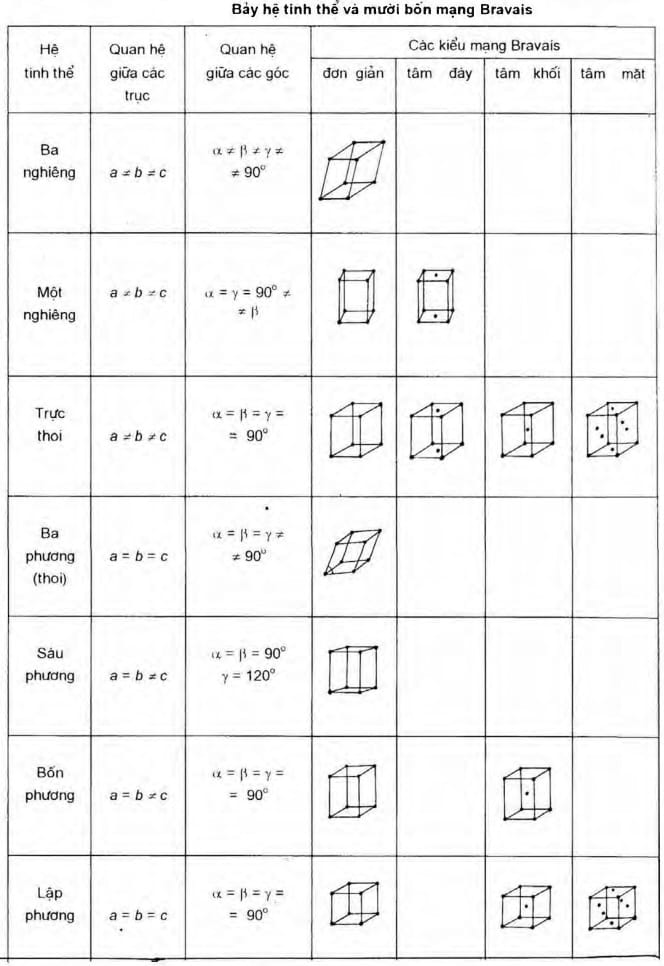
Tùy thuộc vào tương quan giữa các cạnh và góc của ô cơ sở có bảy hệ tinh thể khác nhau,
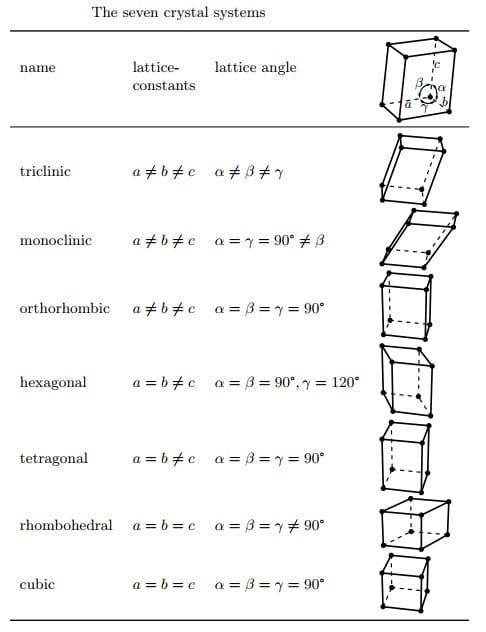
Bằng cách tịnh tiến đưa các phần tử (nguyên tử, ion hay phân tử) lên tâm các mặt bên, tâm đáy hoặc tâm các ô cơ sở đơn giản, hay nói cách khác nếu không quan tâm đến tính đối xứng của các phần tử tại nút mạng tinh thể, chỉ khảo sát vị trí của chúng, thấy rằng chỉ có 14 cách tịnh tiến các phần tử trong không gian để nhận được 14 kiểu mạng tinh thể khác nhau thuộc bảy hệ tinh thể nói trên. Đó là 14 kiểu mạng tinh thể Bravais. Tất cả các mạng tinh thể của chất rắn đều biểu diễn bằng một trong 14 kiểu mạng Bravais như bảng bên dưới
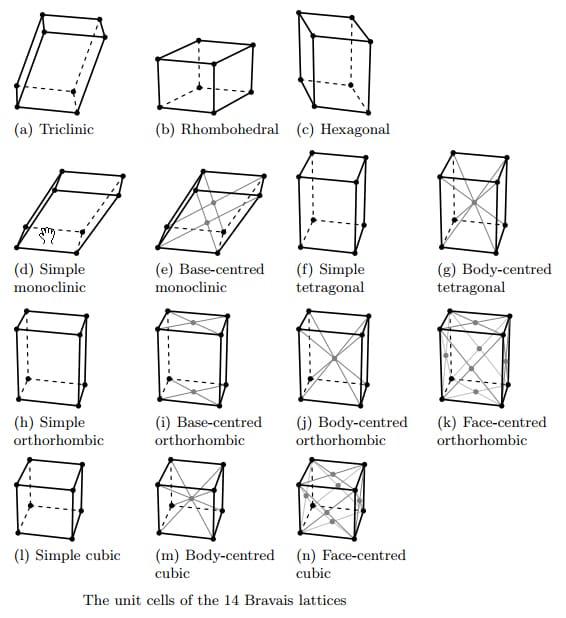
Bảng tổng hợp 7 hệ tinh thể và 14 mạng Bravais
Các kiểu mạng tinh thể thường gặp của kim loại
-
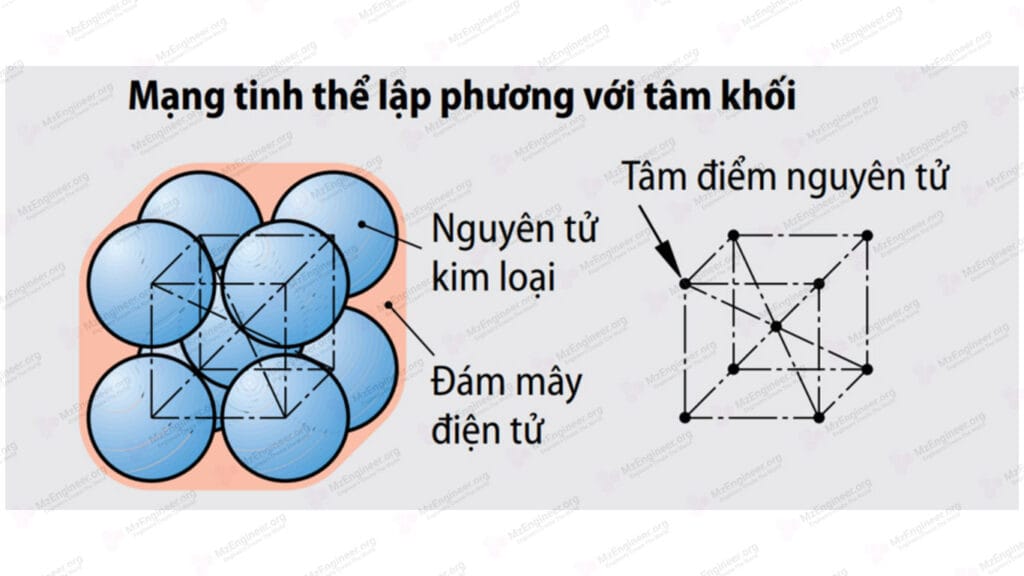
Mạng tinh thể lập phương tâm khối (thể tâm)
Các nguyên tử nằm ở các đỉnh và ở trung tâm của khối lập phương. Nếu coi các nguyên tử là hình cầu và biểu diễn gần như thật thì các nguyên tử nằm ở các đỉnh chéo nhau thì tiếp xúc với nhau qua nguyên tử ở trung tâm. Các nguyên tử còn lại không tiếp xúc nhau. Kiểu mạng này có trong các kim loại FeαCr, Mo, V. Khoảng cách gần nhất giữa hai nguyên tử là \(d = \frac{{a\sqrt 3 }}{2}\) và \(r = \frac{{a\sqrt 3 }}{4}\). Kiểu mạng này có một thông số mạng là a. Kiểu mạng này có số sắp xếp là K8, nghĩa là bất kỳ nguyên tử nào cũng có 8 nguyên tử cách đều nó một khoảng gần nhất
-
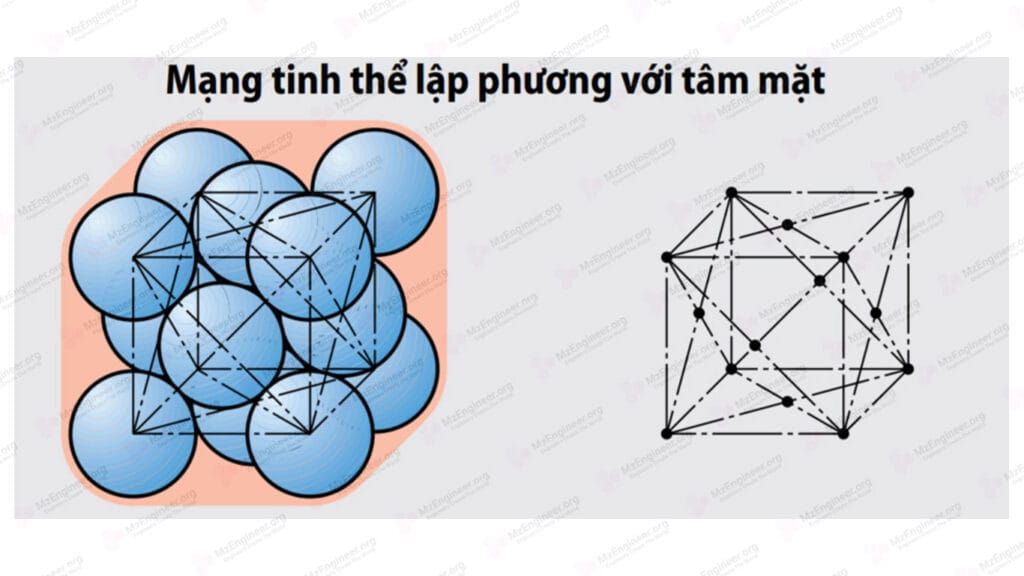
Mạng tinh thể lập phương tâm mặt (thể tâm)
Các nguyên tử nằm ở các đỉnh và tâm của các mặt bên. Nếu coi các nguyên tử hình cầu và biểu diễn gần như thật thì nguyên tử nằm ở đỉnh và tâm của các mặt bên thì tiếp xúc với nhau. Các nguyên tử còn lại không tiếp xúc với nhau. Khoảng cách gần nhất giữa 2 nguyên tử là \(d = \frac{{a\sqrt 2 }}{2}\) và \(r = \frac{{a\sqrt 2 }}{4}\). Kiểu mạng này chỉ có một thông số mạng là a. Thường gặp trong các kim loại Feγ, Cu, Ni, Al, Pb,… Số sắp xếp của mạng là K12
-
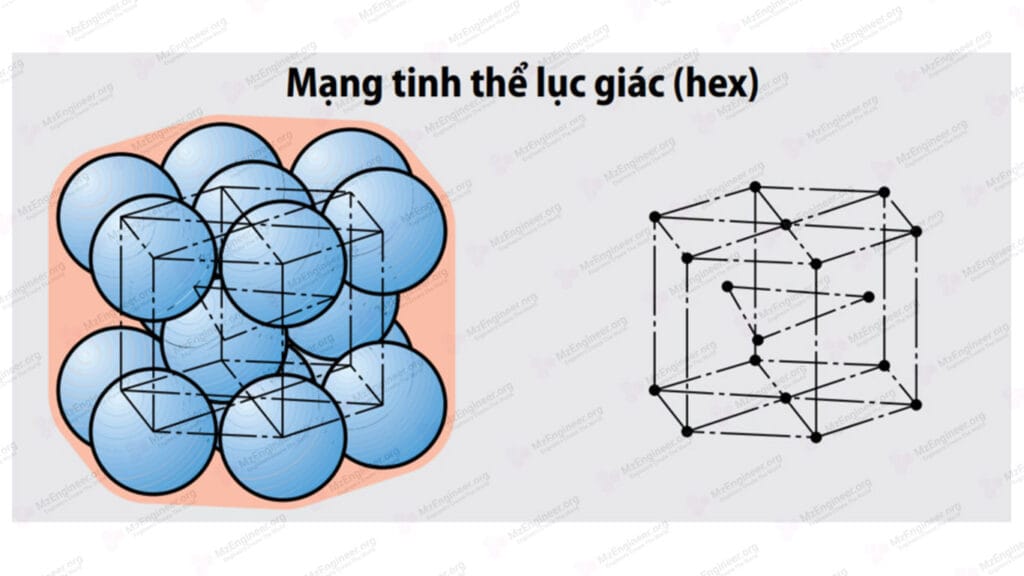
Mạng tinh thể lục giác sáu phương xếp chặt
Các nguyên tử nằm ở các đỉnh và ở hai tâm mặt đáy của hình lăng trục lục giác đều. Ba nguyên tử nằm ở trung tâm ba lăng trụ tam giác cách nhau. Sáu phương xếp chặt có hai thông số mạng là a và c, tỉ số c/a gọi là hệ số xếp chặt. Trong trường hợp lý tưởng \(\frac{c}{a} = \sqrt {\frac{8}{3}} \approx 1,633\). Trong thực tế tỉ số c/a không đúng là 1,633 mà dao động trong khoảng 1,57÷1,64 và cũng được xem là xếp chặt. Các kim loại có kiểu mạng này là Zn, Cd, Coα, Mg, Ti, Ru,…
-
Mạng tinh thể chính phương tâm khối (thể tâm)
Trong tổ chức của thép sau khi tôi (mactexit) còn có kiểu mạng chính phương tâm khối. Có thể coi kiểu mạng này lập phương tâm khối được kéo dài theo một chiều. Nó có 2 thông số mạng là a và c, tỉ số c/a gọi là độ chính phương
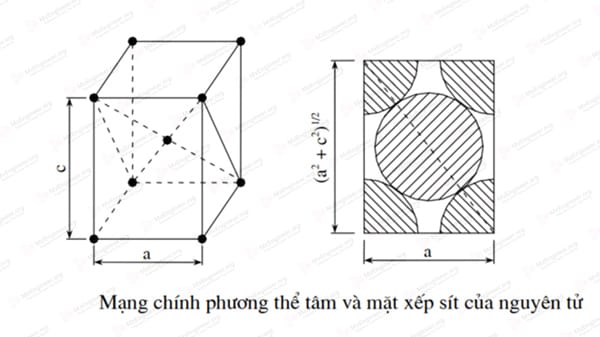
Trong thực tế sự sắp xếp của các nguyên tử trong kim loại theo xu hướng dày đặc nhất. Do đó không có kim loại nào có kiểu mạng đơn giản chính phương tâm khối cả.
-
Mạng tinh thể kim cương
Kim cương là một dạng thù hình của carbon, phân bố điện tử trong nguyên tử carbon là 1s2 2s2 2p2 vậy số điện tử lớp L tham gia liên kết là bốn (N=4), số sắp xếp sẽ là K=4 tức là mỗi một nguyên tử carbon có bốn nguyên tử bao quanh gần nhất cách đều \(a = \frac{{a\sqrt 3 }}{4}\)
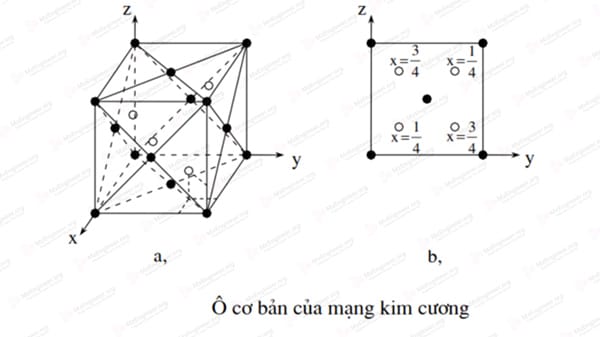
-
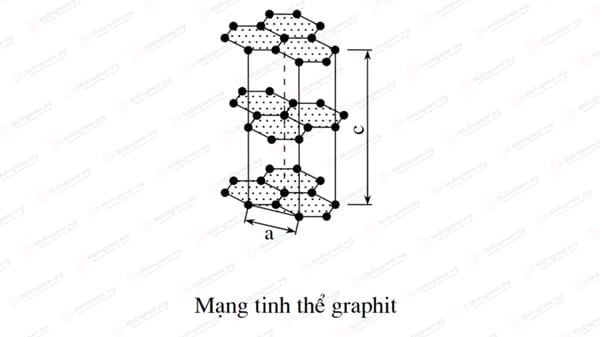
Mạng tinh thể Graphic
Graphic cũng là một dạng thù hình của carbon có mạng tinh thể lục giác lớp với các thông số mạng a = 2,46Å, c = 6,82Å (1Å (angstrom) ≈ 0.1 nm)
3. Cấu tạo mạng tinh thể thực tế












